Główne tezy analizy:
1. Przedmiotem analizy są podstawowe aspekty obrotu środkami antykoncepcji postkoitalnej i tabletkami o działaniu poronnym. Poruszono kwestie związane z charakterystyką ww. produktów, ich sytuacją na gruncie prawa obowiązującego w Polsce i w odniesieniu do kontekstu międzynarodowego.
2. W Polsce sprzedaż środków poronnych w celu samodzielnego przerwania ciąży jest sprzeczna z prawem, w związku z czym w legalnym obrocie brak jest tabletek z ww. substancjami ze wskazaniem do stosowania w aborcji farmakologicznej.
3. Internetowa sprzedaż produktów poronnych jako nielegalna na gruncie aktualnego stanu prawnego stanowi kolejny problem wymagający podjęcia skutecznych działań przez organy ścigania.
4. Praktyka pokazuje, że obowiązujące przepisy KK nie stanowią realnej przeszkody uniemożliwiającej handel tabletkami używanymi w celu samodzielnego wykonywania aborcji. Istnieje bowiem wiele organizacji, które za pośrednictwem Internetu świadczą pomoc w uzyskaniu tabletek poronnych na terenie Polski.
5. Z punktu widzenia problematyki obrotu tabletkami poronnymi na terytorium Polski zasadnicze znaczenie ma przepis art. 152 § 2 KK, zgodnie z którym odpowiedzialność karną ponosi osoba, która udziela kobiecie ciężarnej pomocy w przerwaniu ciąży z naruszeniem przepisów ustawy o planowaniu rodziny lub ją do tego nakłania.
6. W świetle tej normy: [a] działaniem o charakterze nielegalnym będzie każdy przypadek aborcji farmakologicznej wykonanej przez osobę, która nie jest do tego uprawniona, [b] sprawcą takiego przestępstwa może być każdy, kto pomaga kobiecie w przerwaniu ciąży, przy czym określenie „pomoc” w tym przypadku oznacza również sprzedaż środków poronnych za pośrednictwem Internetu.
7. W tym zakresie jako postulat de lege ferenda warto odwołać się do formułowanego w literaturze poglądu, że w przypadku przestępstw internetowych uzasadnione jest przyjęcie, że miejscem działania sprawcy przestępstwa formalnego jest zarówno miejsce, w którym sprawca przebywał popełniając czyn zabroniony, jak również miejsce, w którym znajduje się system komputerowy, na który sprawca oddziaływał.
8. Niezależnie od charakteru produktów określonych przez wnioskodawców w procedurze rejestracyjnej, URPL powinien każdorazowo przeprowadzać dokładną analizę ich właściwości i na tej podstawie decydować o możliwości wydania pozwolenia na dopuszczenie do obrotu.
9. Przedstawione w analizie wyniki badań naukowych wskazują, że wbrew powszechnie panującemu przekonaniu substancje wykorzystywane w „tabletkach awaryjnych” charakteryzuje działanie wczesnoporonne. Na gruncie obowiązujących w Polsce przepisów środki te są dostępne w obrocie jako produkty lecznicze do stosowania w antykoncepcji. Wykazany ich odmienny charakter daje jednak uzasadnione podstawy do zmiany kwalifikacji tych produktów jako środki poronne, których sprzedaż jest prawnie zakazana.
10. Państwa Członkowskie Unii Europejskiej zostały wyposażone w możliwość zakazania lub ograniczenia obrotu środkami antykoncepcyjnymi i poronnymi na swoim terytorium, co w przypadku udowodnionych wczesnoporonnych właściwości antykoncepcji postkoitalnej zyskuje dodatkowe uzasadnienie.
11. Dla potrzeb obrotu produktami leczniczymi zasadne wydaje się ponadto uzupełnienie polskiego prawodawstwa we własną definicję początku ciąży, odmienną od przyjętej przez WHO, a jednocześnie odzwierciedlającą konstytucyjną zasadę ochrony życia ludzkiego od momentu poczęcia.
1. Wstęp
Przedmiotem analizy są podstawowe aspekty obrotu środkami antykoncepcji postkoitalnej i tabletkami o działaniu poronnym. Poruszono kwestie związane z charakterystyką ww. produktów, ich sytuacją na gruncie prawa obowiązującego w Polsce i w odniesieniu do kontekstu międzynarodowego. Zwrócono uwagę na zagadnienia, które pozostają kontrowersyjne i wymagają dalszych badań oraz debaty: m.in. w celu określenia dokładnego mechanizmu działania substancji czynnych zawartych w tzw. tabletkach awaryjnych, jak również momentu, od którego prawnej ochronie podlega ludzkie życie w fazie prenatalnej. Podkreślono możliwość korzystania z dostępnych instrumentów prawnych pozwalających na wyeliminowanie lub przynajmniej ograniczenie obrotu produktami antykoncepcyjnymi i poronnymi.
2. Pojęcia i definicje
2.1. Antykoncepcja postkoitalna („awaryjna”, „doraźna”, „ratunkowa”, „po stosunku”)
Termin „antykoncepcja postkoitalna” używany jest dla określenia ogółu metod zapobiegania ciąży stosowanych w przypadkach nagłych, tj. po stosunku płciowym bez zastosowania skutecznego zabezpieczenia lub w przypadku niepowodzenia stosowanej metody antykoncepcji. Powszechnie dla określenia zbioru tych metod używa się również pojęć antykoncepcja „awaryjna”, „ratunkowa”, „doraźna”, „po stosunku”. Zgodnie z zaleceniami Światowej Organizacji Zdrowia (WHO) antykoncepcja postkoitalna ma szerokie zastosowanie po stosunku seksualnym, obejmujące m.in. następujące sytuacje:
- braku stosowania jakiejkolwiek metody zapobiegania ciąży,
- przemocy seksualnej, w przypadku której kobieta nie była chroniona skuteczną metodą antykoncepcji,
- obawy o możliwą nieskuteczność stosowanej metody antykoncepcji (np. w przypadku pęknięcia lub niewłaściwego użycia prezerwatywy, pominięcia 3 lub więcej kolejnych regularnie stosowanych doustnych tabletek antykoncepcyjnych, ponad 3 godzin opóźnienia w przyjęciu pigułki zawierającej wyłącznie progestagen – tzw. „minipigułki”, etc.)[1].
Światowa Organizacja Zdrowia wyróżnia 4 metody antykoncepcji postkoitalnej:
- tabletka zawierająca substancję czynną o nazwie octan uliprystalu (UPA),
- tabletka, w skład której wchodzi substancja czynna o nazwie lewonorgestrel (LNG),
– oba rodzaje (UPA i LNG) mające status awaryjnych tabletek antykoncepcyjnych (emergencycontraceptionpills – ECPs),
- połączone doustne tabletki antykoncepcyjne (combined oral contraceptive pills – COCs),
- wkładki wewnątrzmaciczne (intrauterine devices – IUD) zawierające miedź.[2]
Ponadto, w niektórych źródłach jako metodę antykoncepcji awaryjnej podaje się także tabletki zawierające mifepriston[3]. Substancja czynna mifepriston stosowana jest w tabletkach poronnych, których obrót w wielu krajach jest nielegalny. Obecnie mifepriston jest wykorzystywany jako metoda antykoncepcji postkoitalnej wyłącznie w Armenii, Mołdawii, na Ukrainie, w Chinach, Rosji i Wietnamie[4].
2.2. „Tabletki awaryjne” jako forma antykoncepcji postkoitalnej. Rodzaje „tabletek awaryjnych” dostępnych w Polsce
Pigułki zawierające substancję czynną octan uliprystalu albo lewonorgestrel stanowią podstawową formę antykoncepcji postkoitalnej. W zależności od rodzaju substancji czynnej Międzynarodowe Konsorcjum ds. Antykoncepcji Awaryjnej (ICEC – International Consortium for Emergency Contraception) podaje następujące informacje dotyczące stosowania „tabletek awaryjnych”:
|
Tabela 1 Skład, dawkowanie, popularne marki tabletek awaryjnych |
||
|
Skład i dawka |
Liczba tabletek |
Popularne marki |
|
Levonorgestrel1.5 mg |
1 |
Escapelle, Plan B One-Step, NorLevo 1.5, Vikela, Postinor 1. |
|
Levonorgestrel0.75 mg |
2 |
Levonelle-2, NorLevo 0.75, Next Choice, Postinor 2 |
|
UlipristalAcetate30 mg |
1 |
ella, ellaOne |
|
Mifepristone25 mg |
1 |
Ciel |
|
Źródło: ICEC: Pill Formulations, https://www.cecinfo.org/what-is-ec/pill-formulations/, dostęp: 27.04.2020 |
||
Światowa Organizacja Zdrowia podaje identyczne zalecenia w kwestii dawkowania doustnych środków zawierających UPA i LNG. Tabletki zawierające mifepriston nie zostały uwzględnione przez WHO jako metoda antykoncepcji doraźnej. Światowa Organizacja Zdrowia podaje jednak dodatkową, łączoną metodę antykoncepcji postkoitalnej (COCs) określaną jako Metoda Yuzpe. W metodzie tej stosuje się połączenie dwóch dawek etynyloestradiolu i LNG – jedna dawka 100 μg etynyloestradiolu i 0,50 mg LNG, a następnie druga dawka 100 μg etynyloestradiolu i 0,50 mg LNG dwanaście godzin później.[5] Metodę Yuzpe stosuje się jako metodę antykoncepcji „ratunkowej” w przypadku, gdy tabletki o wskazaniu do stosowania jako antykoncepcja w przypadkach nagłych nie są w ogóle dostępne lub dostęp do nich jest ograniczony.[6]
Tabletki zawierające substancje octan uliprystalu i lewonorgestrel stanowią grupę produktów leczniczych ze wskazaniem do stosowania w antykoncepcji „awaryjnej” również na terytorium Polski. Zgodnie z danymi znajdującymi się w rejestrze produktów leczniczych, dostępnym w serwisie internetowym Centrum Systemów Informacyjnych Ochrony Zdrowia (CSIOZ), ważne pozwolenie na dopuszczenie do obrotu w Polsce mają następujące tabletki, w skład których wchodzi substancja o nazwie octan uliprystalu (UPA):
|
Tabela 2 Wykaz tabletek awaryjnych zawierających UPA dopuszczonych do obrotu w Polsce |
||||||||
|
Nazwa |
Nazwa powszechnie stosowana |
Moc |
Postać |
Nr pozwolenia |
Ważność pozwolenia |
Podmiot odpowiedzialny |
Typ procedury |
Kod ATC |
|
Eginilla |
Ulipristaliacetas |
30 mg |
tabletki powlekane |
25527 |
2024-09-04 |
EgisPharmaceuticals PLC |
DCP |
G03AD02 |
|
ellaOne |
Ulipristalum |
30 mg |
tabletka |
Laboratoire HRA Pharma |
CEN |
G03AD02 |
||
|
ellaOne |
Ulipristalum |
30 mg |
tabletka powlekana |
Laboratoire HRA Pharma |
CEN |
G03AD02 |
||
|
Misstala |
Ulipristaliacetas |
30 mg |
tabletki powlekane |
25332 |
2024-05-10 |
Alvogen Pharma Trading Europe EOOD |
DCP |
G03AD02 |
|
UlipristalAristo |
Ulipristaliacetas |
30 mg |
tabletki powlekane |
25198 |
2024-03-19 |
Aristo Pharma GmbH |
DCP |
G03AD02 |
|
Źródło: http://pub.rejestrymedyczne.csioz.gov.pl/#results, dostęp: 29.04.2020 |
||||||||
|
Tabela 3 Wykaz tabletek awaryjnych zawierających LNG dopuszczonych do obrotu w Polsce |
||||||||
|
Nazwa |
Nazwa powszechnie stosowana |
Moc |
Postać |
Nr pozwolenia |
Ważność pozwolenia |
Podmiot odpowiedzialny |
Typ procedury |
Kod ATC |
|
Escapelle tabletka 1500 mikrogramów |
Levonorgestrelum |
1500 mcg |
tabletka |
431/17 |
2022-12-22 |
InPharm Sp. z o.o. |
IR |
G03AD01 |
|
Escapelle tabletka 1500 mikrogramów |
Levonorgestrelum |
1500 mcg |
tabletka |
361/18 |
2023-12-18 |
Delfarma Sp. z o.o. |
IR |
G03AD01 |
|
Escapelle tabletka 1500 mikrogramów |
Levonorgestrelum |
1500 mcg |
tabletki |
12048 |
Bezterminowe |
Gedeon Richter Plc. |
MRP |
G03AD01 |
|
Escapelle tabletka 1500 mikrogramów |
Levonorgestrelum |
1500 mcg |
tabletki |
414/13 |
2023-09-25 |
Pretium Farm Sp. z o.o. |
IR |
G03AD01 |
|
Livopill |
Levonorgestrelum |
1,5 mg |
tabletki |
25976 |
2025-08-12 |
Exeltis Poland Sp. z o.o. |
MRP |
G03AD01 |
|
Halyone |
Levonorgestrelum |
1500 mcg |
tabletki |
25674 |
Bezterminowe |
Laboratorios Leon Farma, S.A. |
DCP |
G03AD01 |
Pozwolenie na dopuszczenie do obrotu w Polsce posiadają także doraźne środki antykoncepcyjne zawierające lewonorgestrel (LNG):
Źródło: http://pub.rejestrymedyczne.csioz.gov.pl/#results, dostęp: 29.04.2020
2.3. Octan uliprystalu jako substancja czynna awaryjnych tabletek antykoncepcyjnych
Z informacji dostępnych w serwisie CSIOZ wynika, że pozwolenie na dopuszczenie do obrotu w Polsce ze wskazaniem do stosowania w antykoncepcji doraźnej uzyskało 5 produktów leczniczych zawierających UPA. W każdym z tych produktów znajduje się 30 mg substancji czynnej octanu uliprystalu. W dalszej części rozdziału wykorzystane zostaną dane dotyczące tabletki ellaOne jako reprezentatywnej dla wszystkich tych produktów.
Podstawowy dokument określający właściwości leku – Charakterystyka Produktu Leczniczego ellaOnepodaje następujący mechanizm działania substancji czynnej: „octan uliprystalu jest doustnym, syntetycznym, selektywnym modulatorem receptora progesteronowego o wysokim powinowactwie wiązania do tego receptora u ludzi. W przypadku stosowania jako antykoncepcja w sytuacji nagłej, mechanizm działania polega na hamowaniu lub opóźnianiu owulacji poprzez wstrzymanie wyrzutu hormonu lutenizującego (LH) [podkreśl. autora]. Dane farmakodynamiczne pokazują, że zażyty nawet bezpośrednio przed spodziewaną owulacją (…), octan uliprystalu jest w stanie opóźnić pękanie pęcherzyków przez co najmniej 5 dni w 78,6% przypadków (…)”[7]. Podobna informacja znajduje się w ulotce dla pacjentów: „ellaOne zawiera substancję o nazwie octan uliprystalu, wpływającą na aktywność naturalnego hormonu – progesteronu, którego obecność jest niezbędna w celu wystąpienia owulacji. W rezultacie lek powoduje opóźnienie owulacji. [podkreśl. autora]”. Z cytowanych dokumentów zatwierdzonych w procedurze dopuszczania leku do obrotu wynika, że mechanizm działania octanu uliprystalu ogranicza się do zaburzania przebiegu owulacji. Jednocześnie zarówno ChPL, jak i ulotka produktu ellaOnepodają, że UPA nie powoduje przerwania istniejącej ciąży[8], sugerując, że nie jest to substancja o charakterze poronnym.
W tym kontekście podkreślić należy, że wspomniane działanie octanu uliprystalu, polegające na zapobieganiu ciąży poprzez hamowanie owulacji, dotyczy wyłącznie fazy przedowulacyjnej. Przyjmowanie tabletki ellaOne zaleca się natomiast w dowolnym momencie cyklu miesiączkowego. Jednocześnie nie został opisany mechanizm działania UPA w przypadku przyjęcia leku ellaOne w fazie poowulacyjnej, w sytuacji, w której doszło do zapłodnienia komórki jajowej. ChPL i ulotka zawierają w tym zakresie wskazanie, aby w przypadku opóźnienia cyklu miesiączkowego lub wystąpienia objawów ciąży przed zażyciem tabletki wykluczyć ciążę[9]. Ponadto, w Charakterystyce produktu ellaOne znajdują się pewne skąpe i niejasne informacje, odnoszące się do mechanizmu działania UPA w sytuacji, gdy owulacja miała miejsce i w efekcie doszło do poczęcia dziecka. W szczególności należy zwrócić uwagę na następujące fragmenty ChPLellaOne: „Po przyjęciu octanu uliprystalu może sporadycznie dojść do zajścia w ciążę. Pomimo że nie stwierdzono wpływu teratogennego, wyniki badań na zwierzętach są niewystarczające, aby ocenić toksyczny wpływ na reprodukcję [podkreśl. autora] (patrz punkt 5.3). Ograniczona ilość danych dotyczących ryzyka narażenia kobiety w ciąży na zastosowanie ellaOne nie sugeruje zagrożenia bezpieczeństwa [podkreśl. autora]”[10] oraz „Informacje pochodzące z badań dotyczących toksycznego wpływu na reprodukcję są ograniczone z powodu braku pomiarów narażenia w ramach tych badań. Z powodu mechanizmu działania octan uliprystalu ma wpływ embrioletalny u szczurów, królików (w powtarzanych dawkach powyżej 1 mg/kg) i małp. W przypadku takich powtarzanych dawek bezpieczeństwo dla zarodków ludzkich jest nieznane [podkreśl. autora]”[11]. Przytoczone wyżej dane z badań dotyczących produktu leczniczego zawierającego 30 mg octanu uliprystalu wskazują wyraźnie, że mechanizm działania tej substancji w przypadku jej stosowania po zapłodnieniu ludzkiej komórki jajowej nie został w wystarczającym stopniu zbadany pod kątem możliwych zagrożeń dla zarodka.
Ponadto, dane farmakologiczne znajdujące się w Raporcie Komitetu ds. Produktów Leczniczych Stosowanych u Ludzi (CHMP – The European Medicines Agency’s Committee for Medicinal Products for Human Use)[12],oceniającym właściwości tabletki ellaOne na etapie poprzedzającym dopuszczenie do obrotu w UE przez Komisję Europejską[13], wyraźnie wskazują, że „octan uliprystalu zapobiega wiązaniu się progesteronu z jego receptorem, przez co transkrypcja genów normalnie uruchamiana przez progesteron jest blokowana, a białka niezbędne do rozpoczęcia i utrzymania ciąży nie są syntetyzowane [podkreśl. autora]”[14]. Z powyższego wynika, że zatrzymanie, zakłócenie lub opóźnienie owulacji nie stanowi wyłącznego mechanizmu działania octanu uliprystalu. Kilka możliwych efektów działania tej substancji wyraźnie wskazał również podmiot odpowiedzialny we wniosku o dopuszczenie do obrotu produktu ellaOne. W Raporcie CHMP znajduje się informacja, zgodnie z którą wnioskodawca określił następujące mechanizmy działania produktu ellaOne:
- zdolność do blokowania, zakłócania lub opóźniania owulacji,
- zdolność do blokowania lub opóźniania owulacji nawet po wystąpieniu wyrzutu hormonu LH,
- zdolność do opóźniania dojrzewania endometrium prawdopodobnie skutkująca zapobieganiem implantacji[15].
Antyimplantacyjne właściwości UPA znajdują potwierdzenie w dowodach naukowych. W wyniku oceny dokumentacji przedłożonej przez wnioskodawcę CHMP doszedł do wniosku, że znajdująca się w Charakterystyce Produktu Leczniczego informacja „Podstawowym mechanizmem działania jest zatrzymanie lub opóźnienie owulacji, ale zmiany w endometrium mogą także przyczyniać się do skuteczności produktu [podkreśl. autora]” została dostatecznie udokumentowana[16].
Dostępne są także inne badania potwierdzające antyimplantacyjny charakter substancji o nazwie octanuliprystalu:
- „(…) niektóre z najnowszych badań dotyczących mechanizmu działania uliprystalu jako awaryjnego środka antykoncepcyjnego sugerują, że zasadniczo jego działanie polega na zapobieganiu implantacji zarodka, a nie zapobieganiu owulacji. (…) Próbki z biopsji endometrium badane [w sytuacji, gdy UPA podano po wystąpieniu owulacji – przyp. autora] następnie wykazują, że podanie uliprystalu powoduje, że tkanka endometrium staje się niegościnna i nie nadaje się do implantacji zarodka [podkreśl. autora] (…).”[17]
- „Lira-Albarrán podała ellaOne® kobietom w najbardziej płodnych dniach przedowulacyjnych: miały one normalną owulację, ale ich endometrium (…) stało się niegościnne: ekspresja 1183 genów była dokładnie przeciwna do obserwowanej w receptywnym endometrium pro-ciążowym. Jest to zgodne z informacjami zawartymi w raporcie oceny EMA-CHMP „EMEA / 261787/2009” (s. 8): po podaniu UPA „białka niezbędne do rozpoczęcia i utrzymania ciąży nie są syntetyzowane”. Konkluzja: Mechanizm działania tabletek awaryjnych polega głównie na zapobieganiu implantacji [podkreśl. autora]”[18].
Powodowanie przez octan uliprystalu zmian w endometrium zostało stwierdzone również w badaniach prowadzonych w USA: „Inne badania koncentrowały się na potencjalnym wpływie UPA na endometrium: stwierdzono, że octan uliprystalu zmienia endometrium, jednak nie zostało ustalone czy zmiana ta może zahamować implantację.”[19]
W kontekście udokumentowanego działania UPA polegającego na zapobieganiu zagnieżdżeniu zarodka w endometrium i w konsekwencji jego dalszemu rozwojowi (a więc działania o charakterze wczesnoporonnym) należy dodać, że informacja o możliwych zmianach w macicy powodowanych przez UPA znajdowała się w pierwotnej wersji ulotki produktu ellaOnez 2009 r. Następnie w nowej wersji ulotki z 2010 r. fragment ten został pominięty.[20]Niezależnie jednak od zmian w treści ulotki produktu ellaOne, informacja o oddziaływaniu octanu uliprystalu na błonę śluzową macicy pozostała dostępna w ramach streszczenia Europejskiego Publicznego Sprawozdania Oceniającego (EPAR – European Public Assessment Report): „Hormon płciowy, progesteron, wpływa na wystąpienie owulacji i przygotowanie wyściółki macicy do przyjęcia zapłodnionej komórki jajowej [podkreśl. autora]. Substancja czynna produktu ellaOne, octan uliprystalu, działa jako modulator receptora progesteronu. Oznacza to, że łączy się z receptorami, z którymi normalnie wiąże się progesteron, hamując w ten sposób działanie hormonu [podkreśl. autora]”[21].
Na działanie wczesnoporonne tabletki ellaOne w 2011 r. zwrócili uwagę naukowcy z Uniwersytetu w Padwie na łamach „Italian Journal of gynaecology and obstetrics”, głównego czasopisma ginekologicznego i położniczego we Włoszech. Dochodząc do wniosków odbiegających od informacji zawartych w dokumentacji rejestracyjnej tabletki ellaOnewłoscy naukowcy wykazali, że „(…) środek ellaOne czyni «niegościnnym» endometrium, czyli błonę śluzową wyścielającą macicę, w ten sposób uniemożliwia zagnieżdżenie się dziecku już poczętemu w odpowiednim środowisku [podkreśl. autora] (por. Cosmi, Mozzanega 2013: 195). Działanie antyimplantacyjne pigułki «pięć dni później» polega na ścieśnieniu, skurczeniu endometrium. Badania naukowców z Padwy pokazały, że w rzeczywistości tylko u niewielu kobiet, które stosują ten preparat, następuje przesunięcie owulacji. Wśród kobiet, które na początku dni płodnych, czyli w ciągu 3–4 dni przed owulacją, przyjmowały pigułkę ellaOne, tylko w 25% przypadków nastąpiło przesunięcie owulacji. W ciągu ostatnich dwóch dni przed uwolnieniem komórki jajowej owulacja już się w ogóle nie opóźnia, a ellaOnefunkcjonuje jako placebo w stosunku do owulacji, natomiast działa cały czas jako środek antyimplantacyjny. Bruno Mozzanega i Erik Cosmi wykazali naukowo, że ellaOne rzadko opóźnia owulację, natomiast zawsze czyni niegościnnym endometrium [podkreśl. autora]. Jeśli zapłodnienie nastąpiło przed przyjęciem tabletki «pięć dni później» lub jeśli nastąpi niedługo po tym, to nie dokona się implantacja i nastąpi sztuczne poronienie (por. Cosmi, Mozzanega 2011). Naukowcy włoscy zwrócili uwagę na to, że «w zapobieganiu ciąży» przez preparat ellaOne decydujące znaczenie ma działanie antyimplantacyjne w odniesieniu do endometrium, natomiast o wiele mniejszą rolę odgrywa działanie antyowulacyjne”[22].Istnieją zatem liczne dowody naukowe potwierdzające, że uniemożliwienie implantacji zarodka (działanie wczesnoporonne) nie jest ubocznym i dodatkowym, lecz podstawowym mechanizmem działania octanu uliprystalu – substancji wykorzystywanej w antykoncepcji doraźnej.
2.4. Lewonorgestrel jako substancja czynna awaryjnych tabletek antykoncepcyjnych.
W legalnym obrocie na terenie Polski znajdują się również awaryjne tabletki antykoncepcyjne zawierające substancję czynną lewonorgestrel. Wszystkie produkty z tej grupy posiadają dawkę 1500 µg tego składnika, w związku z czym jako reprezentatywny w dalszej części omówiony zostanie jeden z nich – produkt leczniczy o nawie handlowej Halyone. W Charakterystyce tego leku znajduje się następująca informacja: „Dokładny mechanizm działania produktu leczniczego Halyone nie jest znany. Uważa się, że lewonorgestrel stosowany zgodnie z zaleceniami działa głównie poprzez zapobieganie owulacji i zapłodnieniu [podkreśl. autora], o ile stosunek płciowy miał miejsce w okresie przedowulacyjnym, kiedy prawdopodobieństwo zapłodnienia jest największe. Może również powodować zmiany w błonie śluzowej macicy, utrudniając implantację zarodka [podkreśl. autora]. Produkt leczniczy Halyone nie jest skuteczny, jeśli proces implantacji już się rozpoczął”[23]. Również w ulotce dla pacjentów, zatwierdzonej w procedurze dopuszczania do obrotu, znajduje się następująca informacja o mechanizmie działania substancji LNG: „Uważa się, że lek Halyone działa poprzez:
- hamowanie uwalniania komórki jajowej przez jajniki;
- uniemożliwienie zapłodnienia już uwolnionej komórki jajowej; lub
- powstrzymanie zapłodnionego jajeczka przed zagnieżdżeniem się w błonie śluzowej macicy [podkreśl. autora]”[24].
Przytoczone fragmenty dokumentów rejestracyjnych leku Halyone pokazują, że:
- lek został dopuszczony do obrotu jako bezpieczny i skuteczny, mimo że dokładny sposób jego działania nie został poznany;
- mechanizm działania lewonorgesterlu obejmuje ingerencję w endometrium uniemożliwiającą implantację zarodka i jego dalszy rozwój.
Sposób, w jaki tabletki zawierające LNG zapobiegają ciąży, jest więc zasadniczo taki sam jak w przypadku produktów z octanem uliprystalu – przy zastosowaniu w fazie przedowulacyjnej – antyowulacyjny, natomiast jeżeli owulacja nastąpiła i doszło do zapłodnienia komórki jajowej – antyimplantacyjny. Przy czym, w przeciwieństwie do leków z octanem uliprystalu, działanie antyimplantacyjne LNG zostało uwzględnione w dokumentach rejestracyjnych leku Halyone. W przypadku dopuszczonych do obrotu w Polsce leków z tą substancją można jednak zaobserwować pewną niespójność informacji zawartych w Charakterystykach i ulotkach tych produktów. Podczas gdy w ChPL i ulotce leku Halyone działanie antyimplantacyjne zostało wyrażone wprost, o tyle informacja ta została pominięta w ChPL i ulotkach dla pozostałych leków zawierających lewonorgestrel– Escapelle i Ramonna[25]. Podkreślić trzeba przy tym, że Escapelle i Ramonna zawierają dokładnie tę samą dawkę tej samej substancji czynnej (1500 µ glewonorgestrelu) co produkt o nazwie Halyone.
Nie tylko ta kwestia dotycząca produktów z LNG budzi wątpliwości. Z rejestru dostępnego w serwisie CSIOZ wynika, że produkty zawierające 1500 µg LNG do stosowania w antykoncepcji awaryjnej, w tym lek Halyone, posiadają kategorię dostępności Rp czyli wydawane są z apteki na podstawie recepty lekarskiej[26]. Identyczna informacja dotycząca leku Halyone widnieje w Biuletynie Informacji Publicznej Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (URPL), zawierającym „Wykaz Produktów Leczniczych, które uzyskały pozwolenie na dopuszczenie do obrotu w grudniu 2019r.”[27] Kategoria dostępności Rp została podana również w ulotce produktu Halyone. Jednakże w „Decyzji Prezesa URPL w przedmiocie przedłużenia ważności pozwolenia na dopuszczenie do obrotu produktu leczniczego Halyone” jako kategoria dostępności wymieniona jest kategoria Lz, charakteryzująca ten lek jako stosowany wyłącznie w lecznictwie zamkniętym.[28] Jest prawdopodobne, że niezgodność ta jest wyłącznie efektem błędu pisarskiego. Nasuwa się jednak pytanie czy istnieje korelacja pomiędzy wspomnianą niespójnością a okolicznością, że wyłącznie w dokumentacji dla leku Halyone znalazły się informacje o działaniu antyimplantacyjnym LNG w dawce 1500 µg.
3. Antykoncepcja postkoitalna a tabletki poronne. Kryteria rozróżnienia „awaryjnych” tabletek antykoncepcyjnych i doustnych środków poronnych
3.1. Charakterystyka tabletek poronnych
Pigułki określane jako „awaryjne” zaliczane są do grupy środków antykoncepcyjnych, tj. zapobiegających ciąży. Charakterystyki dopuszczonych do obrotu w Polsce leków z UPA do stosowania jako antykoncepcja doraźna podają informację: „Octan uliprystalu nie powoduje przerwania istniejącej ciąży”[29]. Podobnie, zgodnie z dokumentacją dotyczącą tabletek zawierających 1500µg LNG: „Nie spowoduje on przerwania ciąży”[30].
W obrocie odrębną kategorię powinny zatem stanowić doustne produkty lecznicze o charakterze poronnym jako takie, które powodują przerwanie istniejącej ciąży (aborcja farmakologiczna). Światowa Organizacja Zdrowia, promująca powszechny dostęp do tzw. bezpiecznej aborcji, w celu przerwania ciąży zaleca przede wszystkim stosowanie łącznie dwóch substancji –mifepristonu i mizoprostolu, ewentualnie samego mizoprostolu. Substancje te zostały uznane przez WHO za skuteczne, bezpieczne a ponadto istotne dla systemu opieki zdrowotnej, dlatego też znajdują się na Liście Leków Podstawowych Światowej Organizacji Zdrowia (WHO List of EssentialMedicines)[31]. Mifepriston jest antagonistą receptora progesteronowego hamującym działanie progesteronu, hormonu niezbędnego do podtrzymania ciąży, i tym samym powodującym jej przerwanie. Mizoprostol powoduje zmiękczanie i rozszerzanie szyjki macicy oraz wywołuje skurcze macicy. Ze względu na te właściwości wykorzystywany jest przy indukcji porodu, naturalnym lub sztucznym poronieniu oraz by zapobiec krwotokom poporodowym[32]. W Polsce sprzedaż środków poronnych w celu samodzielnego przerwania ciąży jest sprzeczna z prawem, w związku z czym w legalnym obrocie brak jest tabletek z ww. substancjami ze wskazaniem do stosowania w aborcji farmakologicznej. Ponieważ jednak mizoprostolposiada jeszcze inne zastosowania medyczne, jest dostępny na polskim rynku w następujących produktach leczniczych:
- Cytotec200 µg, tabletki (Misoprostolum)–stosowanym w zapobieganiu owrzodzeniom żołądka i dwunastnicy powstałym w trakcie leczenia niesteroidowymi lekami przeciwzapalnymi (NLPZ)[33],
- Arthrotec50 mg + 0,2 mg, tabletki (Diclofenacumnatricum + Misoprostolum)–wskazany do stosowania u pacjentów wymagających jednoczesnego stosowania niesteroidowego leku przeciwzapalnego (diklofenak) z mizoprostolem. Diklofenak wchodzący w skład produktu Arthrotec jest wskazany w leczeniu objawowym choroby zwyrodnieniowej stawów oraz reumatoidalnego zapalenia stawów. Mizoprostol jest wskazany w leczeniu pacjentów, u których istnieje konieczność profilaktyki owrzodzenia żołądka lub dwunastnicy wywołanego przez leki z grupy NLPZ[34].
Oba produkty lecznicze ze wskazaniem do stosowania w ww. przypadkach znajdują się w legalnym obrocie na terytorium Polski. Poza zarejestrowanymi wskazaniami leczniczymi wykorzystywane są jednak do przeprowadzania aborcji farmakologicznej[35]. Ww. produkty lecznicze posiadają kategorię dostępności Rp, ich nabycie w aptece jest zatem możliwe dzięki okazaniu recepty lekarskiej.
Ponadto, w 2018 r. pozwolenie na dopuszczenie do obrotu w Polsce uzyskał lek o nazwie Angusta, zawierający łącznie w 8 tabletkach200 µg mizoprostolu. Zgodnie z ChPL jest on wskazany do indukcji porodu od 37 tygodnia ciąży[36]. W pkt. 4.6. Charakterystyki znajduje się jednak informacja, że lek ten nadaje się również do stosowania przed 37 tygodniem ciąży. Wprawdzie zostało doprecyzowane, że lek można stosować przed 37 tygodniem ciąży „(…) wyłącznie, gdy istnieją wskazania kliniczne do indukcji porodu (patrz punkt 4.4)”, nie zmienia to jednak faktu, że jest on dopuszczony do obrotu i może być potencjalnie wykorzystywany jako środek poronny poza kontrolą lekarską. Sytuacja taka wydaje się prawdopodobna, biorąc pod uwagę następujące okoliczności:
- istnieją powszechnie dostępne wytyczne, np. opracowane przez WHO, określające ilość i sposób dawkowania mizoprostolu potrzebnego do wykonania aborcji farmakologicznej[37],
- lek Angusta posiada kategorię dostępności Rp (wydawany z przepisu lekarza)[38], podczas gdy w pkt. 4.4. ChPL wyraźnie zaznaczono, że „(…) powinien być podawany wyłącznie przez wyszkolony personel położniczy w warunkach szpitalnych [podkreśl. autora], umożliwiających stałe monitorowanie stanu płodu i czynności macicy”; w tym kontekście przyznana produktowi kategoria dostępności Rp, a nie Lz (do stosowania wyłącznie w lecznictwie zamkniętym) można uznać za nieuzasadnioną.
Z powyższego wynika, że chociaż obrót środkami poronnymi na terytorium Polski co do zasady jest niezgodny z prawem, środki te w rzeczywistości są dostępne i mogą być wykorzystywane do przerywania ciąży w przypadkach prawnie niedozwolonych.
3.2. Podział tabletek na „awaryjne” i „poronne”
Przedstawiony wyżej podział na tabletki awaryjneoraz tabletki poronne w praktyce nie jest jednak tak jednoznaczny, jak mogłybysugerować chociażby ich Charakterystyki czy powszechnie dostępne informacje o antykoncepcji postkoitalnej. W szczególności należy zwrócić uwagę, że w dokumentach rejestracyjnych leków zawierających LNG oprócz zapewnienia, że substancja ta nie spowoduje przerwania istniejącej ciąży, znajduje się również informacja: „Lewonorgestrel nie jest skuteczny, jeśli proces implantacji już się rozpoczął [podkreśl. autora]”[39]. Zdanie to sugeruje, że omawiane produkty mają wyłącznie charakter antykoncepcyjny, tj. zapobiegający ciąży i jednocześnie nie wykazują działania poronnego, rozumianego jako przerwanie istniejącej ciąży. Te właściwości mają je odróżniać od tabletek stricteporonnych, stosowanych w celu przeprowadzenia aborcji. Okazuje się jednak, że zasadnicze znaczenie dla ustalenia czy dany produkt leczniczy traktowany jest jako środek o charakterze poronnym, czy jako tabletka antykoncepcyjna, ma określenie początku ciąży. Jeżeli bowiem do okresu ciąży nie wlicza się czasu od zapłodnienia komórki jajowej do jej implantacji w endumetrium, to informacja: „lek Halyone działa poprzez powstrzymanie zapłodnionego jajeczka przed zagnieżdżeniem się w błonie śluzowej macicy [podkreśl. autora]” nie będzie wskazywała na działanie wczesnoporonne tego produktu. Ciąża w takim przypadku rozumiana jest jako stan mający swój początek w momencie zagnieżdżenia się zapłodnionej komórki jajowej w błonie śluzowej macicy. Etap poprzedzający implantację nie jest więc uznawany za etap ciąży, wobec czego działanie antyimplantacyjnema nie stanowi aborcji. Stanowisko to pośrednio wyrażono w dokumentach rejestracyjnych dostępnych w Polsce „tabletek awaryjnych”. Jest ono zgodne z definicją „ciąży” ustaloną przez WHO: „Trzydzieści lat temu WHO przyjęła, że ciąża rozpoczyna się w momencie zagnieżdżenia się zarodka w macicy a nie w trakcie połączenia się dwóch komórek rozrodczych: męskiej i żeńskiej. Skoro preparat „dzień później” nie dopuszcza do implantacji zarodka, skoro tylko zapobiega jego zagnieżdżeniu w łonie matki, to w świetle tej definicji nie można mówić o sztucznym poronieniu czy działaniu aborcyjnym”[40]. Definicja ta akceptowana jest przez wiele środowisk medycznych na świecie, np. Narodowy Instytut Zdrowia w USA czy Amerykańskie Kolegium Położników i Ginekologów: „ciąża zaczyna się od momentu, gdy zapłodniona komórka jajowa zagnieżdża się w błonie śluzowej macicy [podkreśl. autora]. Implantacja rozpoczyna się od pięciu do siedmiu dni po zapłodnieniu komórki jajowej, a proces ten kończy się kilka dni później. Antykoncepcja awaryjna nie zadziała, jeśli kobieta jest już w ciąży”[41].Koncepcja ciąży rozpoczynającej się w momencie implantacji zarodka wyrażona została również w cytowanym wyżej streszczeniu EPAR dla produktu ellaOne: „Aby doszło do zajścia w ciążę, konieczna jest owulacja (…), a następnie zapłodnienie komórki jajowej (…) i jej zagnieżdżenie w macicy [podkreśl. autora]”. Uzasadniona wydaje się teza, że koncepcję tę zaakceptowały również polskie organy państwowe, w szczególności Prezes URPL, który na tej podstawie wydaje pozwolenia na dopuszczenie do obrotu tabletek awaryjnych, jako produktów nie posiadających właściwości poronnych. Stanowisko to jest jednak sprzeczne z przyjętą w Polsce prawną ochroną życia obejmującą również początkowy etap fazy prenatalnej.
Podsumowując, wbrew dostępnym oficjalnym informacjom[42] i powszechnie panującemu przekonaniu, pojęcie tabletek poronnych powinno w Polsce obejmować również dostępne antykoncepcyjne „tabletki awaryjne”. Wyniki badań klinicznych dowodzą bowiem, że środki te wykazują przede wszystkim działanie antyimplantacyjne a nie antyowulacyjne, przez co powodują przerwanie ciąży na jej najwcześniejszym etapie (działanie wczesnoporonne).
4. Status prawny „tabletek awaryjnych” i tabletek poronnych w świetle prawa obowiązującego w Polsce
4.1. Status prawny „awaryjnych” tabletek antykoncepcyjnych.
Kwestie związane z obrotem lekami w Polsce regulują przede wszystkim przepisy ustawy z dnia 6 września 2001 r. – Prawo farmaceutyczne (dalej jako: UPF)[43], implementującej postanowienia dyrektywy 2001/83/WE Parlamentu Europejskiego i Rady z dnia 6 listopada 2001 r. w sprawie wspólnotowego kodeksu odnoszącego się do produktów leczniczych stosowanych u ludzi (dalej jako: Dyrektywa 2001/83)[44]. Ponadto, w przypadku leków dopuszczanych do obrotu w unijnej procedurze scentralizowanej, zastosowanie ma rozporządzenie (WE) nr 726/2004 Parlamentu Europejskiego i Rady z dnia 31 marca 2004 r. ustanawiające unijne procedury wydawania pozwoleń dla produktów leczniczych stosowanych u ludzi i do celów weterynaryjnych i nadzoru nad nimi oraz ustanawiające Europejską Agencję Leków (Rozporządzenie 726/2004)[45]. Dodatkowo aktem prawnym, którego przepisy mają praktyczne przełożenie na kwestię dostępności produktów leczniczych na polskim rynku, jest rozporządzenie Ministra Zdrowia z dnia 14 listopada 2008 r. w sprawie kryteriów zaliczenia produktu leczniczego do poszczególnych kategorii dostępności (Rozporządzenie MZ)[46].
W świetle przepisów obowiązujących na terytorium RP „tabletki awaryjne” posiadają status produktów leczniczych. Wspomniane akty prawne dostarczają w tym zakresie jednolitej definicji tego rodzaju towarów: „produktem leczniczym jest substancja lub mieszanina substancji, przedstawiana jako posiadająca właściwości zapobiegania lub leczenia chorób występujących u ludzi lub zwierząt lub podawana w celu postawienia diagnozy lub w celu przywrócenia, poprawienia lub modyfikacji fizjologicznych funkcji organizmu poprzez działanie farmakologiczne, immunologiczne lub metaboliczne” (art. 2 pkt 32 UPF)[47]. W świetle tej definicji środki doustnej antykoncepcji postkoitalnej:
- nie stanowią grupy produktów służących profilaktyce lub leczeniu chorób, ich stosowanie nie ma na celu również diagnostyki, przywrócenia lub poprawienia funkcjonowania organizmu,
- spełniają ostatnie z ww. kryteriów, tj. powodują modyfikację fizjologicznych funkcji organizmu kobiety poprzez działanie farmakologiczne – w efekcie ich stosowania zachodzą zmiany uniemożliwiające poczęcie dziecka lub jego rozwój w macicy.
Kryterium modyfikacji naturalnych czynności organizmu zasadniczo rożni się od pozostałych elementów definicji produktu leczniczego. Użyty w UPF termin „modyfikacja” („zmiana” w Dyrektywie 2001/83) nie jest bowiem ograniczony do aspektu pozytywnego, tzn. skutkującego poprawieniem stanu któregokolwiek organu czy organizmu jako całości. Wynika z tego, że działanie modyfikujące określonego produktu leczniczego obejmuje również jego negatywny wpływ na prawidłowe funkcjonowanie organizmu. Dostępne informacje o mechanizmie działania substancji UPA i LNG dostarczają argumentów dla tezy, że z taką sytuacją mamy do czynienia w przypadku awaryjnych tabletek antykoncepcyjnych. Na podstawie tak skonstruowanej definicji doustne środki o działaniu antyowulacyjnym i antyimplantacyjnym mogą funkcjonować w obrocie jako produkty lecznicze.
4.2. Status tabletek awaryjnychw Dyrektywie 2001/83 i orzecznictwie TSUE
Kwalifikacja preparatów o działaniu modyfikującym funkcjonowanie organizmu (nie wykazujących jednocześnie działania terapeutycznego) do kategorii produktów leczniczych jest kwestią kontrowersyjną. Podobną sprawą zajmował się Trybunał Sprawiedliwości UE w połączonych sprawach C‑358/13 i C‑181/14[48]. Wprawdzie podstawą orzekania przez TSUE były przepisy Dyrektywy 2001/83, a okoliczności faktyczne obejmowały obrót substancjami halucynogennymi, jednak analizowany przez Trybunał zakres pojęcia „produktu leczniczego” jest tożsamy na gruncie polskiej UPF i Dyrektywy 2001/83. W omawianym wyroku Sąd krajowy zwrócił się do TSUE z wnioskiem o wyjaśnienie czy pojęcie „produktu leczniczego” z art. 1 pkt 2 lit. b) Dyrektywy 2001/83 należy interpretować jako wyłączające substancje, których działanie ogranicza się do zwykłej zmiany funkcji fizjologicznych, nie powodując ich poprawy, a są spożywane wyłącznie w celu wywołania stanu odurzenia i w konsekwencji są szkodliwe dla zdrowia ludzkiego. Udzielając odpowiedzi na to pytanie Trybunał wskazał, że dany produkt jest produktem leczniczym, jeżeli posiada cechy jednego z dwóch ww. elementów definicji[49]. Dodał jednak, że prawidłowa wykładnia pojęcia „produkt leczniczy” nie pozwala na rozdzielenie poszczególnych jego części składowych.
Dla zobrazowania stanowiska TSUE w tej sprawie warto zwrócić uwagę na następujący obszerniejszy fragment uzasadnienia wyroku: „W tym względzie należy stwierdzić, że zgodnie ze zwyczajowym znaczeniem w języku potocznym termin «zmiana» nie przesądza o korzystnym bądź szkodliwym charakterze wywieranych skutków [podkreśl. autora]. Jednakże zgodnie z utrwalonym orzecznictwem przy dokonywaniu wykładni przepisu prawa Unii należy uwzględniać nie tylko jego brzmienie, lecz także jego kontekst oraz cele regulacji, której część ten przepis stanowi (zob. w szczególności wyroki: Merck, 292/82, EU:C:1983:335, pkt 12; Brain Products, C‑219/11, EU:C:2012:742, pkt 13). Zgodnie z motywem 3 dyrektywy 2004/27 konieczne jest dostosowanie przepisów krajowych, mając na uwadze wysoki poziom ochrony zdrowia ludzkiego. W tych warunkach należy odczytywać całość dyrektywy 2001/83, a w szczególności jej art. 1 pkt 2 w świetle tego celu. Ten ostatni nie wyraża zwykłej neutralności działania na zdrowie ludzkie, lecz oznacza korzystny wpływ na nie. W tym względzie należy stwierdzić, że definicja ustanowiona w art. 1 pkt 2 lit. a) dyrektywy 2001/83 odwołuje się do «właściwości leczniczych lub zapobiegających chorobom u ludzi», które to wyrażenie jednoznacznie wskazuje na istnienie korzystnego wpływu na zdrowie ludzkie. Artykuł 1 pkt 2 lit. b) tej dyrektywy odsyła również do zwrotów implikujących istnienie takiego korzystnego wpływu [podkreśl. autora], ponieważ na końcu odwołuje się do «diagnozy leczniczej», a taka diagnoza ma na celu wykrycie ewentualnych chorób w celu poddania ich leczeniu we właściwym czasie. (…) Termin «zmiana» należy zatem interpretować jako obejmujący substancje mogące wywierać korzystny wpływ na funkcjonowanie organizmu ludzkiego, a w konsekwencji na zdrowie ludzkie [podkreśl. autora]. Z powyższych rozważań wynika, że pojęcie «produktu leczniczego» zawarte w art. 1 pkt 2 lit. b) dyrektywy 2001/83 należy interpretować w ten sposób, że wyłącza ono substancje, które wywierają skutki ograniczające się do zwykłej zmiany funkcji fizjologicznych, a nie są w stanie spowodować korzystnych skutków, bezpośrednich lub pośrednich, dla zdrowia ludzkiego[50] [podkreśl. autora]. Wniosku tego nie podważa argument, według którego zasadniczo wykładnia ta jest sprzeczna z wolą prawodawcy, który jako produkty lecznicze określił w art. 4 ust. 4 dyrektywy 2001/83 «środki antykoncepcyjne lub poronne», podczas gdy te ostatnie zmieniają funkcje fizjologiczne, a nie są w stanie spowodować korzystnego skutku dla zdrowia ludzkiego”.
W cytowanym wyroku TSUE zwrócono uwagę na bardzo istotny problem – tabletki antykoncepcyjne (w tym awaryjne) oraz środki poronne są dopuszczane do obrotu jako produkty lecznicze, podczas gdy nie posiadają żadnych cech terapeutycznych uzasadniających ten status.[51]
4.3. Status tabletek awaryjnych w świetle art. 4 ust. 4 Dyrektywy 2001/83
Wątpliwości dotyczące istnienia podstaw do kwalifikowania środków antykoncepcyjnych i poronnych do kategorii produktów leczniczych znalazł wyraz w treści art. 4 ust. 4 Dyrektywy 2001/83: „Niniejsza dyrektywa nie wpływa na stosowanie ustawodawstwa krajowego zabraniającego lub ograniczającego sprzedaż bądź stosowanie produktów leczniczych jako środków antykoncepcyjnych lub poronnych [podkreśl. autora]. Państwa Członkowskie przedstawią Komisji dane przepisy ustawodawstwa krajowego”. Obowiązujące w Polsce prawo unijne nie przesądza zatem, że tabletki awaryjne i poronne powinny znajdować się w obrocie w państwach członkowskich. Dyrektywa wyraźnie pozostawia poszczególnym krajom swobodę stosowania prawa, które ten obrót eliminuje albo przynajmniej ogranicza „…środki antykoncepcyjne lub poronne są objęte szczególną regulacją w odniesieniu do dyrektywy 2001/83, ponieważ państwa członkowskie w art. 4 ust. 4 są upoważnione do stosowania do tych produktów własnych restrykcyjnych przepisów. W tych okolicznościach sytuacja takich produktów w świetle dyrektywy 2001/83 nie jest w żaden sposób porównywalna z sytuacją produktów leczniczych wchodzących w zakres ogólnej regulacji przewidzianej we wskazanej dyrektywie”[52]. Możliwość ograniczenia, a nawet zakazania obrotu tabletkami awaryjnymi w danym kraju członkowskim (również tych dopuszczonych do obrotu w procedurze scentralizowanej jak preparat ellaOne) została potwierdzona przez Komisję Europejską w stanowisku z 28 sierpnia 2017 r.[53]
Warto odnotować również, że w cytowanym wyroku Trybunał wskazał, że właściwe orany państw członkowskich przed wydaniem pozwolenia na obrót danym produktem powinny przeprowadzać szczegółową analizę jego cech charakterystycznych i na tej podstawie decydować, czy środek ten jest objęty zakresem definicji produktu leczniczego, czy też nie: „…w art. 4 ust. 4 tej dyrektywy prawodawca określił jako produkty lecznicze nie konkretne produkty, lecz – w sposób ogólny – całą kategorię produktów”[54]. Na tej podstawie organy krajowe powinny każdorazowo oceniać, czy preparat wykazuje jakiekolwiek działanie terapeutyczne właściwe produktom leczniczym.
4.4.Zmiana kwalifikacji awaryjnych tabletek antykoncepcyjnych – zagrożenia
Na gruncie obowiązujących przepisów powinno być zatem możliwe zakwestionowanie statusu „awaryjnych” tabletek antykoncepcyjnych jako produktów nie posiadających właściwości leczniczych. Celem tej zmiany miałby być całkowity zakaz sprzedaży i stosowania tego rodzaju środków. Z drugiej strony jednak z sytuacją taką wiąże się pewne zagrożenie. Wyeliminowanie z rynku tabletek antykoncepcji doraźnej o statusie leków nie gwarantuje, że nie zostaną one przekwalifikowane do innej kategorii produktów, których wprowadzanie do obrotu podlega mniej restrykcyjnym wymogom. Takimi produktami mogą być np. wyroby medyczne określone w ustawie z dnia 20 maja 2010 r. o wyrobach medycznych[55]. Wprawdzie brak uzasadnionych podstaw do kwalifikowania „tabletek awaryjnych” jako wyroby medyczne, jednak w praktyce na rynku znajdują się produkty, których status wyrobów medycznych może być przedmiotem dyskusji (np. tabletki do ssania w stanach zapalnych gardła). Zakwestionowanie statusu „tabletek awaryjnych” jako produktów leczniczych nie gwarantuje pożądanego efektu w postaci ograniczenia albo wyeliminowania ich z obrotu.
4.5. Stan prawny w polskim porządku krajowym w kontekście legalnego obrotu awaryjnymi tabletkami antykoncepcyjnymi
Dyrektywa 2001/83 przewiduje możliwość ograniczenia obrotu „pigułkami awaryjnymi”, której jednak polski ustawodawca nie wykorzystuje. Jedynym utrudnieniem wpływającym na dostępność tego rodzaju produktów jest właściwa im kategoria dostępności Rp, podczas gdy w większości państw europejskich są dostępne bez konieczności okazania recepty. Powszechna dostępność środków antykoncepcji doraźnej, które – jak wykazano– charakteryzuje działanie wczesnoporonne, budzi uzasadnione zastrzeżenia w świetle norm ustanawiających prawną ochronę życia. Na gruncie obowiązujących w Polsce przepisów życie ludzkie podlega ochronie konstytucyjnej także w początkowej fazie prenatalnej, co akcentował w swoich orzeczeniach Trybunał Konstytucyjny[56]. Również art. 2 ust. 1 ustawy z 6 stycznia 2000 r. o Rzeczniku Praw Dziecka[57] wyraźnie wskazuje, że początkiem życia człowieka jest moment poczęcia. Ustawa o planowaniu rodziny, ochronie płodu ludzkiego i warunkach dopuszczalności przerywania ciąży określa przypadki i warunki, przy spełnieniu których możliwe jest przerwanie ciąży. W świetle tych przepisów w Polsce co do zasady nie jest dozwolony obrót środkami poronnymi (wyjątek stanowią leki o innym zarejestrowanym zastosowaniu, wykorzystywane jednak poza wskazaniami do przerywania ciąży).
Zatem, z jednej strony określone przepisy konstytucyjne i ustawowe ustanawiają ochronę życia od poczęcia, natomiast z drugiej – przepisy innych aktów prawnych przyzwalają na obrót produktami, które unicestwiają życie w najwcześniejszej fazie rozwoju. Widoczna jest tutaj wyraźna niespójność regulacji prawnej i niekonsekwencja polskiego ustawodawcy. Przyczyny takiego stanu rzeczy mogą być różne, wśród nich za prawdopodobny wymienić można problem braku kompleksowej oceny przez URPL rzeczywistych właściwości produktów leczniczych będących przedmiotem wniosków o dopuszczenie do obrotu. Niespójność regulacji może wynikać również z niewłaściwego, opartego na stanowisku WHO podejścia do wyznaczania początku ciąży jako momentu implantacji zarodka w błonie śluzowej macicy. W celu ograniczania obrotu „awaryjnymi” środkami antykoncepcyjnymi być może postulatem, który warto rozważyć, jest wprowadzenie do polskiego ustawodawstwa odrębnej definicji „ciąży” opartej o koncepcję zgodną z wiedzą naukową (życie ludzkie powstaje w momencie kariogamii, nie zaś zagnieżdżenia w macicy), a przez to spójnej z polskim porządkiem konstytucyjnym. W tym kontekście warto przytoczyć stanowisko Papieskiej Akademii Życia z 2000 r., zgodnie z którym: „Ciąża rozpoczyna się w momencie zapłodnienia, a nie od momentu zagnieżdżenia blastocysty w ściance macicy (Pregnancybegins with fertilization and not with the implantation of the blastocyst in the uterinewall). (…) działanie tabletki „dzień później” ma przeważnie (predominantly) charakter antyimplantacyjny(„anti–implantation” function). Tego rodzaju działanie pigułki „dayafter” jest niczym innym jak aborcją, realizowaną przy użyciu środków chemicznych (chemicallyinducedabortion). Spowodowanie usunięcia embrionu poza organizm matki jest zniszczeniem poczętego życia ludzkiego”[58]. Definicja ta miałaby służyć jako bezpośredni punkt odniesienia przy ocenie właściwości produktów kwalifikowanych jako lecznicze w procedurze dopuszczania do obrotu w Polsce.
5. Problematyka dostępności awaryjnych tabletek antykoncepcyjnych
Aktualnie wszystkie doustne preparaty „awaryjne” posiadają status produktów leczniczych z kategorią dostępności Rp, co oznacza, że mogą być wydawane z aptek i na podstawie recepty lekarskiej (również lek Halyone, przy założeniu, że kategoria dostępności Lz została błędnie podana w decyzji Prezesa URPL). Zgodnie z przepisami Rozporządzenia MZ kategoria dostępności Rp oznacza, że tabletki awaryjne należą do grupy leków, które:
- mogą stanowić bezpośrednie lub pośrednie zagrożenie dla życia lub zdrowia ludzkiego, nawet wówczas, gdy są stosowane prawidłowo bez nadzoru lekarskiego, lub
- mogą być często stosowane nieprawidłowo, czego wynikiem może być bezpośrednie lub pośrednie zagrożenie zdrowia ludzkiego, lub
- zawierają substancje, których działanie lecznicze lub niepożądane działania wymagają dalszych badań[59].
Produkty lecznicze o kategorii Rp stanowią grupę środków, których stosowanie – przede wszystkim z uwagi na możliwe niebezpieczeństwo dla życia lub zdrowia ludzkiego – wymaga nadzoru lekarskiego. Zasadniczym problemem w kwestii realnej możliwości nabycia, a następnie niewłaściwego (niezgodnego ze wskazaniami) stosowania tego rodzaju produktów jest fakt, że receptę obejmującą doustną antykoncepcję awaryjną lub nawet lek o działaniu poronnym może wystawić dowolny lekarz, również taki, który ze względu na inną specjalizację nie posiada merytorycznej wiedzy o działaniu substancji czynnych wchodzących w skład takich preparatów.
Ponadto, nadzór lekarski ograniczony jest w tym przypadku wyłącznie do momentu nabycia produktu leczniczego, natomiast nie obejmuje już jego stosowania. Z drugiej strony, w wielu krajach Unii Europejskiej „tabletki awaryjne” ellaOnesą sprzedawane bez konieczności okazania recepty (kategoria dostępności OTC). Sytuacja taka miała miejsce również w Polsce w latach 2015 – 2017, jednak w 2017 r. przywrócona została kontrola lekarska nad sprzedażą tych środków. Ograniczenie dostępności z kategorii OTC na Rp stanowi pewną barierę utrudniającą nabycie tego typu preparatów. Praktyka pokazuje jednak, że bariera ta może być skutecznie omijana dzięki działalności licznych organizacji jak np. Women on Web, które oferują pomoc w uzyskaniu recepty na antykoncepcję awaryjną bez rzeczywistej konsultacji lekarskiej[60]. Radykalne środowiska feministyczne zintensyfikowały tego rodzaju działalność w szczególności po wydaniu wyroku Trybunału Konstytucyjnego z 22 października 2020 r., który wydatnie poprawił standard ochrony życia ludzkiego w Polsce. W praktyce więc ograniczenie w postaci wymogu okazania recepty nie stanowi realnej i skutecznej przeszkody przed uzyskaniem i stosowaniem środków antykoncepcji doraźnej.
Rozporządzenie MZ jako kategorię dostępności produktów leczniczych wymienia także „Lz”, czyli stosowane wyłącznie w lecznictwie zamkniętym. Zgodnie z § 3 tego aktu prawnego, produkt leczniczy zalicza się do kategorii dostępności „Lz” w sytuacji, gdy z uwagi na swe właściwości farmakologiczne, sposób podawania, wskazania, innowacyjność lub ze względu na interes zdrowia publicznego jest zarezerwowany dla leczenia, które może być przeprowadzone tylko w lecznictwie zamkniętym. Produkty lecznicze tej kategorii nie mogą być wydawane z apteki w celu stosowania przez pacjenta w warunkach domowych, co z pewnością wpływa na zmniejszenie skali obrotu nimi[61].
5.1. Status prawny tabletek poronnych w Polsce
Przypadki, w których przerwanie ciąży jest w Polsce dopuszczalne, określa art. 4a Ustawy z dnia 7 stycznia 1993 r. o planowaniu rodziny, ochronie płodu ludzkiego i warunkach dopuszczalności przerywania ciąży (dalej jako: ustawa o planowaniu rodziny)[62].W każdej okoliczności, w której zgodnie z przepisami ww. ustawy możliwa jest legalna aborcja, zabieg ten może przeprowadzić lekarz posiadający kwalifikacje określone w rozporządzeniu Ministra Zdrowia z dnia 22 stycznia 1997 r. w sprawie kwalifikacji zawodowych lekarzy, uprawniających do dokonania przerwania ciąży oraz stwierdzania, że ciąża zagraża życiu lub zdrowiu kobiety lub wskazuje na duże prawdopodobieństwo ciężkiego i nieodwracalnego upośledzenia płodu albo nieuleczalnej choroby zagrażającej jego życiu[63]. Ponadto, okoliczności uzasadniające przerwanie ciąży powinny być stwierdzone – w zależności od przypadku – przez innego lekarza niż dokonującego tego zabiegu, albo przez prokuratora[64].
Przerywanie ciąży wbrew przepisom Ustawy o planowaniu rodziny stanowi czyny zabronione określone w art. 152–154 Kodeksu karnego (KK)[65]. Na mocy tych przepisów odpowiedzialności karnej podlegają osoby trzecie biorące udział w przerwaniu ciąży wbrew postanowieniom ustawy o planowaniu rodziny, czy to za zgodą kobiety (art. 152 KK), czy bez jej zgody (art. 153 KK). Z punktu widzenia problematyki obrotu tabletkami poronnymi na terytorium Polski zasadnicze znaczenie ma przepis art. 152 § 2 KK, zgodnie z którym odpowiedzialność karną ponosi osoba, która udziela kobiecie ciężarnej pomocy w przerwaniu ciąży z naruszeniem przepisów ustawy o planowaniu rodziny lub ją do tego nakłania. W świetle tej normy:
- działaniem o charakterze nielegalnym będzie każdy przypadek aborcji farmakologicznej wykonanej przez osobę, która nie jest do tego uprawniona[66],
- sprawcą takiego przestępstwa może być każdy, kto pomaga kobiecie w przerwaniu ciąży, przy czym określenie „pomoc” w tym przypadku oznacza również sprzedaż środków poronnych za pośrednictwem Internetu[67].
5.2. Obrót tabletkami o działaniu poronnym w praktyce
Praktyka pokazuje, że obowiązujące przepisy KK nie stanowią realnej przeszkody uniemożliwiającej handel tabletkami używanymi w celu samodzielnego wykonywania aborcji. Istnieje bowiem wiele organizacji, które za pośrednictwem Internetu świadczą pomoc w uzyskaniu tabletek poronnych na terenie Polski oraz dostarczają wszelkich niezbędnych informacji co do sposobu ich wykorzystania, czy np. związanej z tym odpowiedzialności prawnej. Serwisy zawierają również porady, w jaki sposób zachować się w przypadku zatrzymania przesyłki z tabletkami przez polskie organy państwowe[68].
5.2.1. Dostępnew Polsce produkty i usługi związane z aborcją farmakologiczną
Dla uzyskania informacji o tym jak wykonać aborcję w domu oraz odpowiednich środków do jej przeprowadzenia, nie jest konieczna wizyta u lekarza. Na wielu stronach internetowych bez udostępniane są wyczerpujące informacje w języku polskim w jaki sposób i przy użyciu jakich produktów można dokonać samodzielnie aborcji farmakologicznej. Serwisy internetowe, np. womenonweb.org, womenhelp.org, federa.org.pl, aborcyjnydreamteam.pl, tabletka-poronna.pl, itp., dostarczają wszystkich niezbędnych w tym celu instrukcji oraz umożliwiają nabycie niedostępnych w polskich aptekach tabletek poronnych zawierających Mifepriston i Mizoprostol. Przykładowo, serwis tabletka-poronna.pl funkcjonuje jako sklep internetowy, umożliwiający zakup preparatów do przerywania ciąży w domu. W ofercie „sklepu” jest m.in. dostawa tabletek kurierem do domu, dane kontaktowe do lekarza specjalizującego się w aborcji farmakologicznej, ulotki leków z tłumaczeniem na język polski, film instruktażowy jak postępować w celu przerwania ciąży, itp[69].Zakup tabletek aborcyjnych następuje za pomocą funkcji „Dodaj do koszyka”. W tym przypadku pominięta została nawet usługa zdalnej konsultacji z lekarzem, którą oferują inne serwisy, np. womenonweb.org. Tabletki sprowadzane są kurierem z Holandii na takich zasadach, jak każdy inny produkt, który znajduje się w legalnym obrocie w Polsce. Zakup środków poronnych poprzez serwisy typu womenonweb.org odbywa się na nieco innych zasadach. Poprzedza go zdalna „konsultacja lekarska” mająca formę kwestionariusza. Następnie, „po zakończeniu konsultacji online i jeśli nie ma przeciwwskazań, aborcja medyczna (z tabletkami mifepriston i mizoprostol) zostanie dostarczona pocztą”[70]. Płatność za tabletki odbywa się w formie dobrowolnej wpłaty na rzecz organizacji, przez co zakup tabletek pozornie ma przybrać postać darowizny.
5.2.2. Status tabletek poronnych sprowadzanych z zagranicy na własny użytek
Sprowadzanie do Polski tabletek poronnych z krajów, w których są one dostępne, jest możliwe dzięki przepisowi art. 68 ust. 5 UPF, na mocy którego przywóz z zagranicy produktu leczniczego na własne potrzeby lecznicze w liczbie nieprzekraczającej pięciu najmniejszych opakowań nie wymaga zgody Prezesa URPL. Ustawa nie dodaje, że przywożony produkt leczniczy lub jego odpowiednik powinien posiadać pozwolenie na dopuszczenie do obrotu także w Polsce. W ust. 6 tego przepisu ograniczono jedynie przywożenie na terytorium Polski środków odurzających i substancji psychotropowych. Funkcjonująca do niedawna interpretacja art. 68 ust. 5 UPF uznawała za dozwolony zakup leków za granicą i sprowadzanie ich do Polski za pośrednictwem kuriera lub poczty.W marcu 2018 r. Naczelny Sąd Administracyjny dokonał jednak wykładni pojęcia przywóz z zagranicy produktu leczniczego na własne potrzeby wskazując, że „przez «przywóz» należy rozumieć czynność polegającą na przywiezieniu czegoś, czyli fizycznym zabraniu jakiejś rzeczy (przedmiotu) ze sobą do innego (określonego) miejsca [podkreślenie autora]. Tym samym przywóz produktów leczniczych na własne potrzeby w ramach limitu powinien odnosić się do tak rozumianej czynności. Nie może więc dotyczyć sprzedaży z udziałem poczty lub usług kurierskich [podkreślenie autora]. Chodzi zatem w tym przepisie o bezpośrednie, czynne i osobiste działanie, za które nie można uznać sytuacji, w której dochodzi do sprowadzenia produktu leczniczego w drodze sprzedaży wysyłkowej”[71]. Zgodnie z wykładnią dokonaną przez NSA obecnie zakazana jest więc praktyka, w której środki poronne dostarczane są kupującemu przez osoby trzecie[72].
Na gruncie art. 68 ust. 5 UPF warto odnotować również, że użyto w nim sformułowania „przywóz produktu leczniczego na własne potrzeby lecznicze”. Chociaż tabletki poronne funkcjonują w obrocie jako produkty lecznicze, nie ulega wątpliwości, że w rzeczywistości nie mają one właściwości terapeutycznych. W konsekwencji charakter tych produktów powinien wykluczać sprowadzanie ich do Polski w celach leczniczych, a tym samym z zakresu normy art. 68 ust. 5 UPF[73].
5.2.3. Problematyka ograniczania obrotu tabletkami poronnymi w Polsce
Pomimo istniejących podstaw prawnych do ścigania procederu internetowej sprzedaży środków poronnych działalność taka w praktyce często pozostaje bezkarna. Przeszkodą w pociąganiu do odpowiedzialności osób zajmujących się pomocą w nielegalnym przerywaniu ciąży może być w szczególności okoliczność, że osoby te nie prowadzą działalności na terytorium Polski. Wątpliwości budzi również możliwość kwalifikowania sprzedaży internetowej preparatów poronnych jako formy pomocy w przerwaniu ciąży, jak również przypisania sprawcom odpowiedzialności karnej w sytuacji braku pewności czy skutek w postaci przerwania ciąży nastąpił.
W tym kontekście warto zwrócić uwagę na następujące argumenty wyrażone w doktrynie i rozstrzygnięciach sądów orzekających na gruncie art. 152 § 2 KK:
- działalność polegająca na internetowej sprzedaży środków poronnych oraz udzielaniu instrukcji co do sposobu wykorzystania tych środków w celu przerwania ciąży stanowi przestępstwo z art. 152 § 2 KK: „Istotne jest natomiast to, że R. S., wiedząc o wczesnoporonnych właściwościach leku (…), sprzedawał go wyłącznie w celu, o którym mowa w art. 152 § 2 k.k., a więc w celu udzielenia kobietom ciężarnym pomocy w przerwaniu ciąży[podkreślenie autora]z naruszeniem przepisów ustawy z dnia 7 stycznia 1993 r. o planowaniu rodziny, ochronie płodu ludzkiego i dopuszczalności przerywania ciąży (Dz.U. z 1993 r. nr 17, poz. 78, z późn. zm.). W tym stanie rzeczy jest więc oczywistym, że poprzez swoje bezprawne zachowanie oskarżony dokonał przestępstwa stypizowanego w art. 152 § 2 k.k. (…)”[74],
- czyn zabroniony polegający na udzielaniu pomocy w przerwaniu ciąży jest przestępstwem o charakterze formalnym: „Przestępstwo z art. 152 § 2 k.k. (…) stanowi typ przestępstwa suigeneris obejmującego nakłanianie (synonim podżegania z art. 18 § 2 k.k.) albo pomoc (forma pomocnictwa z art. 18 § 3 k.k.). W sytuacji, gdy chodzi o podżeganie lub pomocnictwo do czynu, który po stronie sprawcy nie jest czynem zabronionym, do podżegania i pomocnictwa w ujęciu art. 152 § 2 k.k. nie stosuje się przepisów części ogólnej Kodeksu karnego dotyczących form współdziałania przestępnego, gdyż takie tutaj nie zachodzi. Zatem zbieżność opisu czynu zabronionego określonego w art. 152 § 2 k.k. z opisem podżegania w art. 18 § 2 k.k. albo pomocnictwa w art. 18 § 3 k.k., odnosi się jedynie do charakterystyki znamion sprawstwa. Jest poza sporem, że przestępstwo z art. 152 § 2 k.k. ma charakter formalny, sprawca odpowiada bez względu na to, czy do przerwania ciąży doszło czy nie [podkreślenie autora]”[75],
- zagraniczny charakter portali internetowych nie powinien być przeszkodą w pociąganiu ich twórców do odpowiedzialności prawnej. W doktrynie podnosi się bowiem, że w przypadku przestępstw internetowych uzasadnione jest przyjęcie, że miejscem działania sprawcy przestępstwa formalnego jest zarówno miejsce, w którym sprawca przebywał popełniając czyn zabroniony, jak również miejsce, w którym znajduje się system komputerowy, na który sprawca oddziaływał. Aktualnie pogląd ten traktowany jest jednak jako postulat de lege ferenda[76].
Przytoczone wyżej stanowisko sądów i doktryny dostarcza istotnych wskazówek w kwestii możliwości ścigania nielegalnego obrotu środkami poronnymi również za pośrednictwem Internetu.
6. Dostęp do antykoncepcji postkoitalnej – elementy prawnoporównawcze.
6.1. Dostęp do antykoncepcji doraźnej w Polsce na tle innych państw europejskich
W 2017 r. z inicjatywy Europejskiego Parlamentarnego Forum Praw Seksualnych i Reprodukcyjnych (EPF – European Parliamentary Forum for Sexual & Reproductive Rights), organizacji zrzeszającej m.in. parlamentarzystów z krajów europejskich, powstał tzw. Atlas Antykoncepcji (Contraception Atlas). Jest to swoisty „ranking” 46 państwach europejskich pod względem dostępności do antykoncepcji – im jest on lepszy, tym wyżej punktowane jest dane państwo[77]:
„Contraception Atlas 2019”
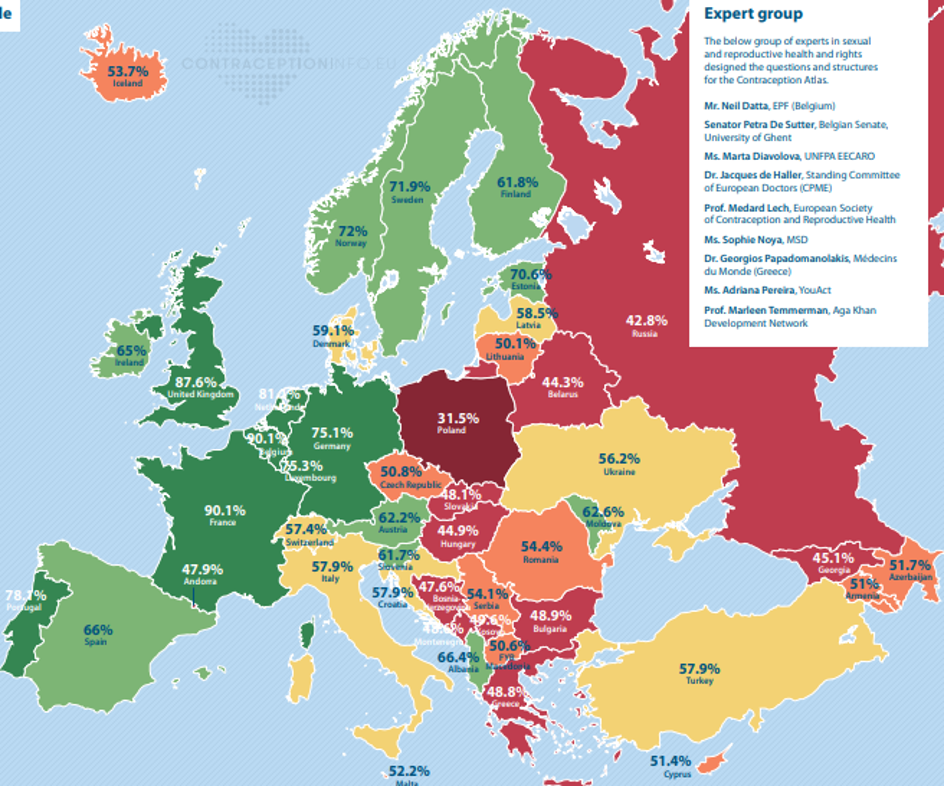
Atlas ukazuje stopień dostępności do środków antykoncepcyjnych oraz informacji dotyczących planowania rodziny w poszczególnych państwach za pomocą kolorów – ciemny zielony oznacza kraje, w których dostęp jest najszerszy, kolory czerwony i brązowy – obszary o dostępie najbardziej ograniczonym.
Z informacji przestawionych w części opisowej Atlasu wynika, że w 2019 r. w zdecydowanej większości państw europejskich „tabletki awaryjne”, zgodnie z lokalnym prawem, były dostępne bez recepty. Antykoncepcja doraźna była również osiągalna bez recepty w Albanii, Bośni i Hercegowinie, Rosji i na Węgrzech, pomimo odmiennych przepisów obowiązujących w tych krajach (Availability of emergencycontraceptionwithoutprescription – Yes [illegal]). Dane przedstawione w Atlasie wskazują Polskę jako jedyny kraj europejski, w którym w 2019 r. antykoncepcja „awaryjna” nie była w ogóle dostępna bez okazania recepty (Availability of emergencycontraceptionwithoutprescription – No).
Wymóg okazania recepty jako ograniczenie dostępu do tabletek zawierających octan uliprystalu do 2015 r. obowiązywał także w takich krajach jak Chorwacja, Niemcy czy Włochy. Ponadto, we Włoszech dodatkowym wymogiem poprzedzającym sprzedaż tabletki awaryjnej z UPA było wykonanie testu ciążowego wykluczającego ciążę[78]. Sytuacja jednak zmieniła się w momencie, gdy Europejska Agencja Leków, zaleciła zmianę kategorii dostępności produktu ellaOnez Rp na OTC[79]. Na tej podstawie Komisja Europejska w styczniu 2015 r. wydała decyzję w sprawie zmiany pozwolenia na wprowadzenie do obrotu produktu leczniczego ellaOne, na mocy której wytwórca uzyskał możliwość sprzedaży preparatu bez recepty we wszystkich państwach UE[80]. Kategoria dostępności OTC dla tabletek ellaOne została przyjęta w Polsce w 2015 r. (stan ten utrzymywał się do 2017 r.) Następnie, do państw, w których możliwa jest sprzedaż ellaOne bez recepty, dołączyła Malta (2016 r.), Gibraltar (2017 r.) oraz Andora (2018 r.)[81]. Jedynie Węgry pozostały krajem, który z uwagi na bezpieczeństwo pacjentów niezmiennie utrzymywał wymóg posiadania recepty na wszystkie środki antykoncepcji „awaryjnej”[82]. Sprzedaż antykoncepcji doraźnej nadal jest tam ograniczona, jednak dane uzyskane przez autorów Atlasu wskazują jednocześnie, że wbrew wymogom prawnym tabletki „awaryjne” są w tym kraju osiągalne także bez recepty.
W świetle powyższego, w 2019 r. Polska prezentowała się jako państwo, które na tle innych krajów europejskich w najwyższym stopniu ogranicza dostęp do tabletek „awaryjnych”. Ograniczenia te nie eliminują jednak zjawiska internetowej „sprzedaży” recept obejmujących antykoncepcję „awaryjną”, wystawianych na podstawie zdalnej konsultacji z osobą uprawnioną do wystawiania recept[83].
6.2. Dostęp do aborcji farmakologicznej w Polsce na tle innych państw
Dane opublikowane na koniec 2019 r. wskazują Polskę jako kraj należący do nielicznej grupy państw europejskich, w których przerywanie ciąży jest prawnie ograniczone, a tym samym standard ochrony życia ludzkiego – w tym życia w stadium prenatalnym – jest stosunkowo wysoki. Poza Rzeczpospolitą do grona tych państw należą Lichtenstein i Monako. Mniej liczną grupę stanowią państwa europejskie, w których aborcja jest prawnie zakazana – obejmuje ona Andorę, San Marino i Maltę[84]. Natomiast na arenie międzynarodowej liczne są państwa, w których przerywanie ciąży jest niezgodne z prawem (np. Afganistan, Syria, Korea Południowa, Somalia, Kongo), albo ograniczone wyłącznie do przypadków zagrożenia życia lub zdrowia kobiety (np. Boliwia, Wenezuela, Irak, Egipt, Madagaskar).[85] W części tych państw nie są również dostępne substancje wykorzystywane w celach poronnych (Mizoprostol).
Wnioski
Przedstawione w analizie wyniki badań naukowych pokazują, że wbrew powszechnie panującemu przekonaniu substancje wykorzystywane w tabletkach awaryjnych charakteryzuje działanie wczesnoporonne. Na gruncie obowiązujących w Polsce przepisów środki te są dostępne w obrocie jako produkty lecznicze do stosowania w antykoncepcji. Wykazany ich odmienny charakter daje jednak uzasadnione podstawy do zmiany kwalifikacji tych produktów jako środki poronne, których sprzedaż jest prawnie zakazana.
Internetowa sprzedaż produktów poronnych jako nielegalna na gruncie aktualnego stanu prawnego stanowi kolejny problem wymagający podjęcia skutecznych działań przez organy ścigania. W tym zakresie jako postulat de lege ferenda warto odwołać się do wspomnianego stanowiska M. Sowy wskazującego na możliwość karania sprawców transgranicznych przestępstw internetowych.
Niezależnie od charakteru produktów określonych przez wnioskodawców w procedurze rejestracyjnej, URPL powinien każdorazowo przeprowadzać dokładną analizę ich właściwości i na tej podstawie decydować o możliwości wydania pozwolenia na dopuszczenie do obrotu. Ponadto, Państwa Członkowskie Unii Europejskiej zostały wyposażone w możliwość zakazania lub ograniczenia obrotu środkami antykoncepcyjnymi i poronnymi na swoim terytorium, co w przypadku udowodnionych wczesnoporonnych właściwości antykoncepcji postkoitalnej zyskuje dodatkowe uzasadnienie.
Dla potrzeb obrotu produktami leczniczymi zasadne wydaje się ponadto uzupełnienie polskiego prawodawstwa we własną definicję początku ciąży, odmienną od przyjętej przez WHO, a jednocześnie odzwierciedlającą konstytucyjną zasadę ochrony życia ludzkiego od momentu poczęcia.
Autorka: r.pr. Katarzyna Gęsiak – Zastępca Dyrektora Centrum Prawa Międzynarodowego Ordo Iuris
[1]World Health Organization, Emergency contraception, 2 February 2018, https://www.who.int/news-room/fact-sheets/detail/emergency-contraception, dostęp: 19.05.2021.
[2]Ibidem.
2European Consortium for Emergency Contraception (ECEC), What is Emergency Contraception?, https://www.ec-ec.org/emergency-contraception-in-europe/what-is-emergency-contraception/, dostęp: 19.05.2021.
[4]J. Trussell, E.G. Raymond, K. Cleland, Emergency Contraception: A Last Chance to Prevent Unintended Pregnancy, January 2019, Princeton University, https://ec.princeton.edu/questions/ec-review.pdf, dostęp: 19.05.2021.
[5]World Health Organization, Emergency contraception…..
[6]ICEC, Using oral birth control pills as EC, December 2014, https://www.cecinfo.org/wp-content/uploads/2014/12/ICEC_Yuzpe_FactSheet_2014.pdf, dostęp: 27.04.2020.
[7]Por. pkt. 5.1. Charakterystyki Produktu Leczniczego ellaOne, https://www.ema.europa.eu/en/documents/product-information/ellaone-epar-product-information_pl.pdf, dostęp: 19.05.2021; taka sama informacja znajduje się w ChPL pozostałych tabletek awaryjnych dopuszczonych do obrotu w Polsce.
[8]Por. pkt 4.6. ChPLellaOne.
[9]Por. pkt. 4.2. ChPLellaOne.
[10]Pkt. 4.6. ChPLellaOne.
[11]Pkt. 5.3. ChPLellaOne.
[12]Jednostka Europejskiej Agencji Leków (EMA – European Medicines Agency) przeprowadzająca ocenę naukową wniosku o dopuszczenie do obrotu i wydająca zalecenie dla Komisji Europejskiej czy dany produkt leczniczy może być wprowadzony do obrotu.
[13]Zgodnie z art. 3 ust. 2 lit. a) Rozporządzenia (WE) nr 726/2004 Parlamentu Europejskiego i Rady z dnia 31 marca 2004 ustanawiającego wspólnotowe procedury wydawania pozwoleń dla produktów leczniczych stosowanych u ludzi i do celów weterynaryjnych i nadzoru nad nimi oraz ustanawiającego Europejską Agencję Leków (Dz.U. L 136 z 30.4.2004).
[14]European Medicines Agency, CHMP Assessment Report for ellaOne, 2009, https://www.ema.europa.eu/en/documents/assessment-report/ellaone-epar-public-assessment-report_en.pdf, s. 8, dostęp: 19.05.2021.
[15]Ibidem, s. 9.
[16]Ibidem, s. 23.
[17]DrugBank, Ulipristal: Mechanism of action, https://www.drugbank.ca/drugs/DB08867 i cytowana tam literatura, dostęp: 19.05.2021.
[18]B. Mozzanega, G.B. Nardelli,UPA and LNG in emergency contraception: the information by EMA and the scientific evidences indicate a prevalent anti-implantation effect,“Eur J Contracept Reprod Health Care” 18(2019), s. 1-7.
[19]J.Trussell, E.G. Raymond, K. Cleland, Emergency Contraception…, s. 8.
[20]Stanowisko Rady Naukowej Centrum Bioetyki Instytutu na Rzecz Kultury Prawnej Ordo Iuris ws. zmiany kategorii dostępności na terenie Polski produktu leczniczego ellaOne z 08.06.2017, https://ordoiuris.pl/ochrona-zycia/rada-naukowa-centrum-bioetyki-ordo-iuris-o-ellaone#_ftn10, dostęp: 19.05.2021.
[21]EMA, Streszczenie EPAR dla ogółu społeczeństwa: ellaOne octan uliprystalu, EMA/764301/2014, https://www.ema.europa.eu/en/documents/overview/ellaone-epar-summary-public_pl.pdf, dostęp: 19.05.2021.
[22]A. Kobyliński, Etyczne i prawne aspekty stosowania preparatu medycznego ellaOne czyli tzw. pigułki „pięć dni później”, „Studia Ecologiae et Bioethicae” 13/1 (2015), s. 9-34.
[23]Pkt. 5.1. ChPLHalyone.
[24]Pkt. 1 ulotki dla leku Halyone.
[25]Por. pkt. 5.1. ChPL i pkt. 1 ulotki dla leków Escapelle i Ramonna.
[26]CSIOZ, Rejestr Produktów Leczniczych, https://pub.rejestrymedyczne.csioz.gov.pl/ProduktSzczegoly.aspx?id=40925, dostęp: 04.05.2020.
[27]BIPURPL,Produktów Leczniczych, które uzyskały pozwolenie na dopuszczenie do obrotu w grudniu 2019 r., poz. 8, http://bip.urpl.gov.pl/sites/default/files/zalaczniki/Biuletyn_2019-12_EAN.pdfdostęp: 19.05.2021.
[28]Decyzja Prezesa URPL z dnia 26 lutego 2020 r. w przedmiocie przedłużenia na czas nieokreślony okresu ważności pozwolenia nr 25674 na dopuszczenie do obrotu produktu leczniczego HalyoneLevonorgestrelum, tabletki, 1500 mikrogramów, Nr UR/RR/0080/20.
[29]Por. pkt. 4.6. ChPL: ellaOne, Eginilla, Misstala, Ulipristal Aristo.
[30]Por. pkt. 4.6. i 5.1. ChPLEmpil i Ramonna.
[31]WHO, Medical Management of Abortion 2018, https://apps.who.int/iris/bitstream/handle/10665/278968/9789241550406-eng.pdf?ua=1, dostęp: 19.05.2021.
[32]Ibidem
[33]Por. ChPLCytotec.
[34]Por. ChPLArthrotec.
[35]Federacja na rzecz Kobiet i Planowania Rodziny, Przerywanie ciąży: metoda farmakologiczna 2020, https://federa.org.pl/wp-content/uploads/2020/03/Federa_aborcja-farmakologiczna_broszura.pdf, dostęp: 19.05.2021.
[36]Por.ChPLAngusta.
[37]Por. WHO, Medical Management…, s. 24-25.
[38]Patrz decyzja Prezesa URPL z dnia 21 czerwca 2018 r. w przedmiocie wydania pozwolenia nr 24780 na dopuszczenie do obrotu produktu leczniczego Angusta, Nr UR/RD/0291/18.
[39]Por. np. pkt. 4.6. i 5.1. ChPLEmpil i Ramonna.
[40]A. Kobyliński, Etyczne i prawne aspekty…, s. 13.
[41] The Emergency Contraception Website, How Emergency Contraception Works: Does emergency contraception cause an abortion?,https://ec.princeton.edu/questions/ecabt.html, dostęp: 19.05.2021.
[42]Por. także ICEC, Emergency contraception and medical abortion: what’s the difference?, February 2013, https://www.cecinfo.org/wp-content/uploads/2014/01/ICEC_Medical-Abortion-Fact-Sheet_Feb-2013.pdf, dostęp: 19.05.2021.
[43]Dz. U. z 2021 r. poz. 97.
[44]Dz.U. L 311 z 28.11.2001, s. 67
[45]Dz.U. L 136 z 30.4.2004, s. 1.
[46]Tekst jedn.: Dz.U. z 2016 r. poz. 1769.
[47]Por. art. 1 pkt 2 Dyrektywy 2001/83 oraz art. 2 Rozporządzenia 726/2004.
[48]Wyrok Trybunału z dnia 10 lipca 2014 r. w sprawach połączonych C‑358/13 i C‑181/14, ECLI:EU:C:2014:2060, http://curia.europa.eu/juris/document/document.jsf;jsessionid=FC76753AC2AED5FDD821451959CA9296?text=&docid=154827&pageIndex=0&doclang=PL&mode=lst&dir=&occ=first&part=1&cid=6600116, dostęp: 19.05.2021.
[49]Wyrok TSUE w sprawach C‑358/13 i C‑181/14, pkt. 28
[50]W tym kontekście warto zwrócić uwagę na zagrożenie wynikające z określanego przez WHO zakresu pojęcia „zdrowie”, obejmującego również tzw. „zdrowie seksualne” („Sexual health is a state of physical, mental and social well-being in relation to sexuality. It requires a positive and respectful approach to sexuality and sexual relationships, as well as the possibility of having pleasurable and safe sexual experiences, free of coercion, discrimination and violence”), https://www.who.int/topics/sexual_health/en/, dostęp: 19.05.2021.
[51]Por. także wyrok TSUE z dnia 30 kwietnia 2009 r. w sprawie C‑27/08, pkt. 18 i 19, ECLI:EU:C:2009:278, http://curia.europa.eu/juris/document/document.jsf?text=&docid=73331&pageIndex=0&doclang=pl&mode=lst&dir=&occ=first&part=1&cid=6602990, dostęp: 19.05.2021.
[52]Wyrok TSUE w sprawach C‑358/13 i C‑181/14, pkt. 40 i 41.
[53]Answer to the Parliamentary questions given by Mr Andriukaitis on behalf of the Commission, E-004885/2017, https://www.europarl.europa.eu/doceo/document/E-8-2017-004885-ASW_EN.html?redirect, dostęp: 19.05.2021.
[54]Ibidem, pkt. 42 i 43.
[55]Dz. U. z 2021 r. poz. 255.
[56]Zob. w szczególności orzecznie Trybunału Konstytucyjnego z 28 maja 1997 r., sygn. K 26/96 oraz wyrok Trybunału Konstytucyjnego z 22 października 2020 r., sygn. K 1/20.
[57]Dz. U. z 2020 r. poz. 141.
[58]A. Kobyliński, Etyczne i prawne aspekty…, s. 16.
[59]§ 1 ust. 1 pkt. 1-3 Rozporządzenia MZ
[60] „Women on Web zapewni Ci receptę na antykoncepcję awaryjną, recepta będzie wystawiona przez europejskiego lekarza”, WomenonWeb, Uzyskaj receptę na antykoncepcję awaryjną ellaOne! – https://www.womenonweb.org/pl/survey/13837/get-a-prescription-for-emergency-contraceptive-ellaone, dostęp: 07.05.2020.
[61]Por. stanowisko Ministra Zdrowia z dna 17 marca 2017 r. w sprawie możliwości stosowania leków o kategorii „Lz” warunkach domowych, PLO.4642.1.2.2017 JM.
[63]Dz.U. Nr 9, poz. 49.
[64]Art. 4a ust. 5 ustawy o planowaniu rodziny.
[65]Ustawa z dnia z dnia 11 września 2019 r. – Kodeks karny (Dz. U. z 2020 r. poz. 1444 z późn. zm.).
[66]Por. R. Kokot, komentarz do art. 152, [w:] Kodeks karny. Komentarz, [red.] R. Stefański, Warszawa 2019, SIP Legalis (wraz z przywołanym tam poglądem A. Zolla).
[67]Por. wyrok Sądu Apelacyjnego w Szczecinie z dnia 14 kwietnia 2016 r., sygn. akt II AKa 36/16
[68]Zob. materiały prasowe dostępne pod adresem: http://codziennikfeministyczny.pl/problem-przesylkami-od-women-web/ dostęp: 19.05.2021.
[69] Zob.https://tabletka-poronna.pl/sklep/tabletki-poronne-cena/, dostęp: 19.05.2021.
[70] Zob.https://www.womenonweb.org/pl/i-need-an-abortion, dostęp: 19.05.2021.
[71]Wyrok Naczelnego Sądu Administracyjnego z dnia 6 marca 2018 r., sygn. akt I GSK 1277/16.
[72] Zob. materiały prasowe dostępne pod adresem:https://www.rynekaptek.pl/prawo/sciaganie-tabletek-poronnych-z-zagranicy-stalo-sie-nieosiagalne,26266.html, dostęp: 19.05.2021.
[73]Chociaż w przypadku produktów zawierających Mizoprostol możliwa jest argumentacja, stosowana zresztą dotychczas przez sprowadzających produkty do Polski, że substancja ta przywożona jest w celu leczenia np. wrzodów żołądka (patrz pkt. I.5. opracowania). W takiej sytuacji należałoby jednak zweryfikować, czy rzeczywiście istnieją jakieś dowody potwierdzające okoliczność istnienia tego rodzaju dolegliwości u osoby, która sprowadziła produkt.
[74]Wyrok Sądu Apelacyjnego w Olsztyniez dnia 14 kwietnia 2016 r., sygn. akt II AKa 36/16.
[75]Wyrok Sądu Najwyższego z dnia 20 listopada 2014 r., sygn. akt IV KK 257/14.
[76]B. Kunicka-Michalska, komentarz doart. 6, [w:]Kodeks karny. Komentarz, [red.] R. Stefański, Warszawa 2019, SIP Legalis.
[77]Atlas Antykoncepcji dostępny na stronie internetowej https://www.contraceptioninfo.eu/ ,dostęp: 19.05.2021.
[78]Zob. https://www.ec-ec.org/emergency-contraception-in-europe/emergency-contraception-availability-in-europe/ dostęp: 19.05.2021.
[79]European Medicines Agency, EMA recommends availability of ellaOne emergency contraceptive without prescription, 21 November 2014, EMA/710568/2014, https://www.ema.europa.eu/en/documents/press-release/ema-recommends-availability-ellaone-emergency-contraceptive-without-prescription_en.pdf, dostęp: 19.05.2021.
[80]Decyzja wykonawcza Komisji Europejskiej C(2015)51 final z 7 stycznia 2015 r. w sprawie zmiany wydanego na mocy decyzji K(2009)4049 pozwolenia na wprowadzenie do obrotu produktu leczniczego stosowanego u ludzi ellaOne – octan uliprystalu (dalej: decyzja C(2015)51 final)
[81]Italia S, Schröder-Bäck P, Brand H. Switching emergency contraceptives to non-prescription status and unwanted pregnancy among adult and teenage women: Along – term European comparative study (Original research). SEEJPH 2020, posted: 17January 2020. DOI:10.4119/seejph-3277, https://www.seejph.com/index.php/seejph/article/view/3277/3363, dostęp: 14.05.2020
[82]ECEC, Emergency Contraception Availability in Europe, October 2018, https://www.ec-ec.org/emergency-contraception-in-europe/emergency-contraception-availability-in-europe/, dostęp: 14.05.2020
[83]Por. np. https://twojarecepta.com.pl/produkt/konsultacja-lekarska-z-mozliwoscia-wystawienia-e-recepty-na-tabletke-dzien-po/?gclid=CjwKCAjw_LL2BRAkEiwAv2Y3SVQDDZpdpESaASP8VfhSmu74zTZKtNbsvQJ4KjN-1MzR5TAoQsK_tBoCppkQAvD_BwE
[84]Barbara Erling, Stanisław Dudzik, Katarzyna Korzeniowska, współpraca Bartosz Chyż,W Europie aborcja dostępna, a w Polsce bez zmian, 24 października 2019 r., https://biqdata.wyborcza.pl/biqdata/7,159116,25342285,aborcja-w-europie-lagodniejsze-przepisy-zabiegow-coraz-mniej.html, dostęp: 14.05.2020
[85]https://www.womenonwaves.org/pl/map/country, dostęp: 14.05.2020